Ikatan kovalen koordinasi adalah salah satu konsep penting dalam ilmu kimia yang sering muncul dalam pembelajaran di tingkat menengah. Meskipun terdengar rumit, pemahaman tentang ikatan ini sangat bermanfaat dalam memahami reaksi kimia, struktur senyawa kompleks, dan peran biokimia dalam tubuh makhluk hidup. Dalam artikel ini, kita akan membahas secara mendalam mengenai pengertian, ciri-ciri, contoh, serta perbedaan antara ikatan kovalen koordinasi dengan jenis ikatan lainnya.
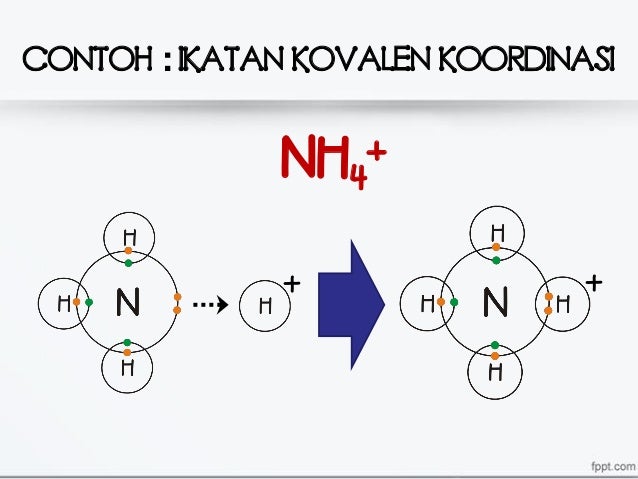
Ikatan kovalen koordinasi terjadi ketika pasangan elektron yang digunakan untuk membentuk ikatan berasal sepenuhnya dari satu atom saja. Berbeda dengan ikatan kovalen biasa yang melibatkan pertukaran elektron antara dua atom, ikatan ini hanya melibatkan satu pihak sebagai donor elektron. Proses ini sering disebut juga sebagai ikatan datif karena hanya satu atom yang "menyumbangkan" elektron. Contoh sederhana dari ikatan ini adalah ion amonium (NH₄⁺), di mana nitrogen menyumbangkan pasangan elektron bebasnya kepada ion H⁺.
Selain itu, ikatan kovalen koordinasi juga sering ditemukan dalam senyawa kompleks, seperti kompleks logam transisi. Dalam senyawa-senyawa ini, atom pusat (biasanya logam) menerima pasangan elektron dari ligan, yaitu molekul atau ion yang menyumbangkan elektron. Contohnya adalah kompleks [Fe(CN)₆]³⁻, di mana Fe³⁺ berikatan dengan enam ion CN⁻ melalui ikatan kovalen koordinasi. Selain itu, ikatan ini juga berperan penting dalam proses biologis, seperti pengangkutan oksigen oleh hemoglobin dalam darah.
Pemahaman tentang ikatan kovalen koordinasi tidak hanya berguna dalam bidang kimia, tetapi juga dalam industri dan teknologi. Banyak senyawa kompleks dengan ikatan kovalen koordinasi digunakan sebagai katalis dalam reaksi kimia, serta dalam produksi pewarna dan bahan kimia lainnya. Selain itu, materi ini sering muncul dalam ujian sekolah, sehingga pemahaman yang baik akan sangat membantu siswa dalam persiapan ujian.
Dengan memahami konsep dasar, ciri-ciri, serta contoh ikatan kovalen koordinasi, siswa dan siswi akan lebih mudah mempelajari topik ini dalam pelajaran kimia. Latihan soal dan observasi pada senyawa kompleks juga akan memperkuat pemahaman kalian terhadap materi ini. Mari kita mulai dengan menjelaskan apa itu ikatan kovalen koordinasi dan bagaimana ia berbeda dari ikatan kovalen biasa.
Apa Itu Ikatan Kovalen Koordinasi?
Ikatan kovalen koordinasi adalah jenis ikatan kimia yang terbentuk ketika satu atom menyumbangkan seluruh pasangan elektron yang digunakan untuk membentuk ikatan. Berbeda dengan ikatan kovalen biasa, di mana setiap atom berkontribusi satu elektron untuk membentuk pasangan bersama, ikatan kovalen koordinasi hanya melibatkan satu atom sebagai donor elektron. Atom lainnya bertindak sebagai akseptor, menerima pasangan elektron tersebut.
Konsep ini sering disebut juga sebagai ikatan datif karena hanya satu pihak yang menyumbangkan elektron. Dalam ikatan ini, pasangan elektron yang dibagikan tetap menjadi milik kedua atom, meskipun hanya satu atom yang memberikannya. Proses ini umumnya terjadi dalam senyawa kompleks, di mana atom logam pusat menerima pasangan elektron dari ligan.
Contoh paling sederhana dari ikatan kovalen koordinasi adalah ion amonium (NH₄⁺). Dalam molekul ini, nitrogen menyumbangkan pasangan elektron bebasnya kepada ion H⁺, membentuk ikatan kovalen koordinasi. Hal ini membuat NH₄⁺ memiliki muatan positif karena ion H⁺ tidak memiliki elektron sendiri.
Ikatan kovalen koordinasi juga sering ditemukan dalam reaksi asam-basa Lewis. Dalam reaksi ini, basa Lewis bertindak sebagai donor pasangan elektron, sedangkan asam Lewis bertindak sebagai akseptor. Contohnya adalah reaksi antara NH₃ (basa Lewis) dan H⁺ (asam Lewis), yang membentuk ion NH₄⁺. Proses ini mirip dengan cara kerja ikatan kovalen koordinasi, di mana satu atom menyumbangkan pasangan elektron ke atom lain.
Ciri-Ciri Ikatan Kovalen Koordinasi
Ikatan kovalen koordinasi memiliki beberapa ciri-ciri khas yang membedakannya dari jenis ikatan kimia lainnya. Berikut ini adalah tiga ciri utama dari ikatan kovalen koordinasi:
1. Pasangan Elektron Asimetris
Salah satu ciri utama dari ikatan kovalen koordinasi adalah adanya pasangan elektron yang berasal sepenuhnya dari satu atom. Dalam ikatan kovalen biasa, pasangan elektron dibagi secara merata antara dua atom. Namun, dalam ikatan kovalen koordinasi, satu atom menyumbangkan seluruh pasangan elektron, sementara atom lainnya hanya menerima dan membaginya. Hal ini menciptakan ketidakseimbangan dalam kontribusi elektron, sehingga disebut sebagai pasangan elektron asimetris.
Contoh dari fenomena ini adalah ion amonium (NH₄⁺). Dalam molekul ini, nitrogen menyumbangkan pasangan elektron bebasnya kepada ion H⁺, membentuk ikatan kovalen koordinasi. Meskipun pasangan elektron ini dibagikan, hanya satu atom (nitrogen) yang menyumbangkannya.
2. Terbentuk Senyawa Kompleks
Ikatan kovalen koordinasi sering ditemukan dalam senyawa kompleks, yaitu senyawa yang terdiri dari atom logam pusat yang dikelilingi oleh ligan. Ligan adalah molekul atau ion yang menyumbangkan pasangan elektron kepada atom logam pusat. Proses ini membentuk struktur koordinasi yang stabil dan khas.
Contoh dari senyawa kompleks adalah kompleks [Fe(CN)₆]³⁻. Dalam kompleks ini, ion Fe³⁺ bertindak sebagai atom logam pusat, sementara enam ion CN⁻ bertindak sebagai ligan. Setiap ion CN⁻ menyumbangkan pasangan elektron kepada Fe³⁺, membentuk ikatan kovalen koordinasi.
Selain itu, ikatan kovalen koordinasi juga ditemukan dalam senyawa biologis seperti hemoglobin. Hemoglobin adalah protein yang bertugas mengangkut oksigen dalam darah. Dalam struktur hemoglobin, ion Fe²⁺ dalam cincin porfirin berikatan dengan molekul oksigen melalui ikatan kovalen koordinasi.
3. Penting dalam Reaksi Kimia
Ikatan kovalen koordinasi memainkan peran penting dalam berbagai reaksi kimia, terutama dalam reaksi asam-basa Lewis dan katalisis oleh senyawa kompleks.
Dalam reaksi asam-basa Lewis, asam bertindak sebagai akseptor pasangan elektron, sedangkan basa bertindak sebagai donor. Contohnya adalah reaksi antara NH₃ (basa Lewis) dan H⁺ (asam Lewis), yang membentuk ion NH₄⁺. Proses ini mirip dengan cara kerja ikatan kovalen koordinasi, di mana satu atom menyumbangkan pasangan elektron ke atom lain.
Di sisi lain, senyawa kompleks dengan ikatan kovalen koordinasi sering digunakan sebagai katalis dalam reaksi kimia. Katalis bekerja dengan menurunkan energi aktivasi reaksi, sehingga reaksi dapat berlangsung lebih cepat. Contohnya adalah kompleks logam seperti platinum atau nikel, yang digunakan dalam reaksi kimia industri.
Reaksi Asam-Basa Lewis
Reaksi asam-basa Lewis adalah jenis reaksi kimia yang melibatkan transfer pasangan elektron antara dua zat. Konsep ini diperkenalkan oleh Gilbert N. Lewis, seorang ahli kimia Amerika. Dalam reaksi ini, asam bertindak sebagai akseptor pasangan elektron, sedangkan basa bertindak sebagai donor pasangan elektron.
Contoh paling sederhana dari reaksi asam-basa Lewis adalah reaksi antara NH₃ (basa Lewis) dan H⁺ (asam Lewis), yang membentuk ion NH₄⁺. Dalam reaksi ini, NH₃ menyumbangkan pasangan elektron bebasnya kepada H⁺, membentuk ikatan kovalen koordinasi. Proses ini mirip dengan cara kerja ikatan kovalen koordinasi, di mana satu atom menyumbangkan pasangan elektron ke atom lain.
Reaksi asam-basa Lewis juga ditemukan dalam berbagai reaksi kimia, termasuk dalam proses biologis. Misalnya, dalam sistem pencernaan, enzim-enzim tertentu bertindak sebagai katalis dalam reaksi kimia, menggunakan prinsip asam-basa Lewis untuk mempercepat proses.
Katalisis oleh Senyawa Kompleks
Katalisis adalah proses mempercepat laju reaksi kimia tanpa mengalami perubahan kimiawi secara permanen. Katalis bekerja dengan menurunkan energi aktivasi reaksi, sehingga reaksi dapat berlangsung lebih cepat. Senyawa kompleks dengan ikatan kovalen koordinasi sering digunakan sebagai katalis dalam berbagai reaksi kimia.
Contoh dari katalis yang menggunakan ikatan kovalen koordinasi adalah kompleks logam seperti platinum atau nikel. Dalam reaksi kimia industri, kompleks logam ini membantu mempercepat reaksi dengan menyediakan jalur alternatif yang memiliki energi aktivasi lebih rendah.
Selain itu, katalisis oleh senyawa kompleks juga ditemukan dalam proses biologis. Enzim-enzim tertentu bertindak sebagai katalis dalam reaksi kimia tubuh, menggunakan prinsip ikatan kovalen koordinasi untuk mempercepat proses.
Biokimia dan Peran Ikatan Kovalen Koordinasi
Biokimia adalah cabang ilmu yang mempelajari proses kimia yang terjadi di dalam makhluk hidup. Ilmu ini menggabungkan prinsip-prinsip kimia dan biologi untuk memahami bagaimana molekul-molekul organik berinteraksi dan membentuk sistem kehidupan yang kompleks.
Ikatan kovalen koordinasi berperan penting dalam berbagai proses biokimia. Salah satu contoh terpenting adalah dalam pengangkutan oksigen oleh hemoglobin dalam darah. Dalam struktur hemoglobin, ion Fe²⁺ dalam cincin porfirin berikatan dengan molekul oksigen melalui ikatan kovalen koordinasi. Proses ini memungkinkan hemoglobin untuk mengangkut oksigen dari paru-paru ke jaringan tubuh.
Selain itu, ikatan kovalen koordinasi juga ditemukan dalam enzim-enzim tertentu. Enzim adalah protein yang bertindak sebagai katalis dalam reaksi kimia tubuh. Beberapa enzim menggunakan ikatan kovalen koordinasi untuk mempercepat reaksi kimia, seperti dalam proses metabolisme dan sintesis molekul.
Perbedaan antara Ikatan Kovalen Biasa dan Ikatan Kovalen Koordinasi
Meskipun keduanya merupakan jenis ikatan kovalen, ikatan kovalen biasa dan ikatan kovalen koordinasi memiliki perbedaan signifikan dalam cara pembentukannya dan sifatnya.
1. Ikatan Kovalen Biasa
Ikatan kovalen biasa terbentuk ketika masing-masing atom yang berikatan menyumbangkan satu elektron untuk membentuk pasangan elektron bersama. Dalam ikatan ini, kedua atom berkontribusi sama-sama terhadap pasangan elektron ikatan.
Contoh dari ikatan kovalen biasa adalah molekul H₂, Cl₂, dan CH₄. Dalam molekul H₂, dua atom hidrogen saling berbagi satu elektron, membentuk ikatan tunggal. Dalam molekul CH₄, atom karbon berbagi elektron dengan empat atom hidrogen.
Ciri utama dari ikatan kovalen biasa adalah bahwa pasangan elektron dibagi secara merata antara dua atom. Simbolik, ikatan ini digambarkan dengan garis tunggal antara atom (misalnya: H–H).
2. Ikatan Kovalen Koordinasi (Dativ)
Ikatan kovalen koordinasi terjadi ketika pasangan elektron ikatan sepenuhnya berasal dari satu atom donor dan dibagikan ke atom lain (akseptor). Dalam ikatan ini, hanya satu atom yang menyumbangkan dua elektron untuk membentuk ikatan.
Contoh dari ikatan kovalen koordinasi adalah molekul NH₄⁺ (ion amonium) dan SO₂ (sulfur dioksida). Dalam molekul NH₄⁺, nitrogen menyumbangkan pasangan elektron bebasnya kepada ion H⁺, membentuk ikatan kovalen koordinasi. Dalam molekul SO₂, atom sulfur menyumbangkan pasangan elektron bebasnya kepada atom oksigen.
Ciri utama dari ikatan kovalen koordinasi adalah bahwa hanya satu atom yang menyumbangkan dua elektron untuk membentuk ikatan. Biasanya, ikatan ini ditunjukkan dengan tanda panah (→) dari atom donor ke atom penerima.
Manfaat Memahami Ikatan Kovalen Koordinasi
Memahami ikatan kovalen koordinasi memiliki banyak manfaat, terutama dalam bidang kimia dan kehidupan sehari-hari. Berikut ini adalah beberapa manfaat utama dari pemahaman tentang ikatan kovalen koordinasi:
1. Memahami Reaksi Kimia Kompleks
Pengetahuan tentang ikatan kovalen koordinasi membantu dalam memahami pembentukan senyawa kompleks. Senyawa kompleks sering ditemukan dalam industri kimia, seperti dalam produksi katalis dan pewarna. Pemahaman tentang ikatan kovalen koordinasi akan mempermudah siswa dalam memahami struktur dan sifat senyawa kompleks.
2. Industri dan Teknologi
Senyawa kompleks dengan ikatan kovalen koordinasi sering digunakan dalam industri kimia, seperti katalis dan pewarna. Contohnya, kompleks logam seperti platinum atau nikel digunakan sebagai katalis dalam reaksi kimia industri. Pemahaman tentang ikatan kovalen koordinasi akan membantu siswa dalam memahami aplikasi praktis dari konsep ini dalam dunia nyata.
3. Memahami Proses Biologis
Ikatan kovalen koordinasi berperan penting dalam reaksi biologis, seperti pengangkutan oksigen dalam darah melalui hemoglobin. Pemahaman tentang ikatan ini akan memperluas pemahaman siswa tentang bagaimana molekul-molekul organik berinteraksi dalam tubuh makhluk hidup.
4. Persiapan Ujian Sekolah
Materi tentang ikatan kovalen koordinasi sering muncul dalam soal ujian, terutama dalam ujian sekolah dan ujian nasional. Pemahaman yang baik akan sangat membantu siswa dalam menghadapi ujian dan meningkatkan hasil belajar mereka.
Kesimpulan
Ikatan kovalen koordinasi adalah salah satu konsep penting dalam ilmu kimia yang memiliki peran besar dalam berbagai reaksi kimia, senyawa kompleks, dan proses biologis. Dengan memahami konsep ini, siswa dan siswi akan lebih mudah mempelajari topik ini dalam pelajaran kimia. Latihan soal dan observasi pada senyawa kompleks juga akan memperkuat pemahaman kalian terhadap materi ini. Selamat belajar dan terus eksplorasi ilmu kimia!


Komentar0